| Bac S 2000 | Inde (juin 2000) | |
| Analyse d'un comprimé de vitamine C |
La vitamine C ou acide ascorbique est vendue en pharmacie sous forme de comprimés "à croquer".
La manipulation décrite par l'exercice, a pour but de retrouver les valeurs :
- de la masse m de vitamine C contenue dans un comprimé ;
- du pKa de cet acide.
 Données numériques à 25 °C :
Données numériques à 25 °C :
L'acide ascorbique ou vitamine C est représenté par la formule simplifiée AH ;
Masse molaire de l'acide ascorbique : MAH = 176 g.mol-1 ;
Constante d'acidité de l'acide ascorbique : pKa = 4,05 ;
Masse d'acide ascorbique contenue dans un comprimé : mC = 5.10-1 g = 500 mg ;
Concentration de la solution de soude utilisée : CB = 2.10-2 mol.L-1 .
Couples acide-base auxquels participe l'eau :
H3O+ / H2O pKa1 = 0
HCO3-/CO32- pKa2 = 14
Indicateur coloré |
Teinte acide |
Zone de virage |
Teinte basique |
Rouge de méthyle |
rouge |
4,2 - 6,2 |
jaune |
Rouge de crésol |
jaune |
7,2 - 8,8 |
rouge |
Hélianthine |
rouge |
3,1 - 4,4 |
jaune |
 Manipulation :
Manipulation :
Le comprimé, soigneusement écrasé, est dissous dans un peu d'eau dans un bécher. Le contenu du bécher est transvasé dans une fiole jaugée de volume V = 100 mL. On complète avec de l'eau distillée jusqu'au trait de jauge ; la solution obtenue est notée S.
On prélève un volume VA = 10 mL de la solution S, on le verse dans un bécher et on y ajoute un volume d'eau distillée de 20 mL environ.
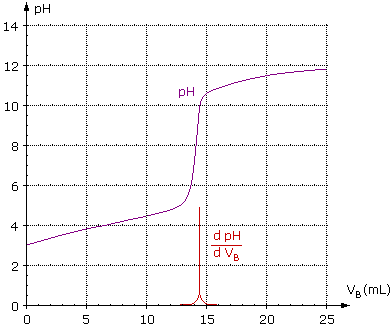
Le dosage pH-métrique assisté par ordinateur de cet échantillon par une solution d'hydroxyde de sodium (ou soude) donne les résultats représentés sur le document I ci-après.
L'utilisation d'un logiciel approprié a permis de tracer rapidement sur ce document :
- le graphe pH = f(VB), VB étant le volume de solution de soude versé ;
- la courbe dérivée dpH/dVB = f(VB). Cette courbe dérivée présente un maximum lorsque l'équivalence E est atteinte.
 Questions :
Questions :
1. a. Écrire l'équation-bilan de la réaction entre la soude et l'acide ascorbique.
1. b. Calculer la constante KR de cette réaction. Conclure.
1. c. Cette réaction rapide et unique peut-elle être utilisée pour faire ce dosage ?
2. a. Définir l'équivalence acidobasique pour ce dosage.
2. b. Déduire du graphe les coordonnées du point d'équivalence E (pHEq ; VB Eq).
2. c. Déterminer la concentration molaire en acide ascorbique CAH de la solution S.
2. d. En déduire la masse m de vitamine C contenue dans un comprimé "à croquer".
2. e. Comparer avec les indications fournies par le fabricant et conclure.
3. a. En utilisant le document I déterminer, en expliquant la méthode utilisée, le pKa du couple HA/A- (dont l'acide ascorbique est la forme acide).
3. b. Comparer avec le résultat fourni.
4. Un élève veut refaire le dosage sans utiliser le pH-mètre et l'ordinateur. Il réalise un dosage colorimétrique.
4. a. Quel est le rôle de l'indicateur coloré ?
4. b. Quel indicateur coloré utiliser parmi ceux proposés ? Pourquoi ?
Document I
Copyright © School Angels 2001