pKa(HCO3-/CO32-) = 10,3 ;
pKa(H2O/OH-) = 14 ;
pKa(H3O+/H2O) = 0 ;
Zone de virage de la phénolphtaléine : 8,2 - 10 (incolore-rose)
Masses molaires atomiques : MNa=23,0 g.mol-1 MC=12,0 g.mol-1 MO=16,0 g.mol-1
I. Étude d'une solution de carbonate de sodium Na2CO3
1. Le carbonate de sodium est un composé ionique soluble dans l'eau.
On prépare une solution de carbonate de sodium dans laquelle on verse quelques gouttes de phénolphtaléine.
Comment interpréter la couleur rose obtenue ?
On prépare une solution de carbonate de sodium dans laquelle on verse quelques gouttes de phénolphtaléine.
Comment interpréter la couleur rose obtenue ?
Dans l'eau, le carbonate de sodium se dissocie et donne des ions sodium (Na+) et des ions carbonate (CO32-).
Les ions sodium sont spectateurs (aucune réaction acido-basique) alors que les ions carbonate (base) réagissent selon la réaction acide base :
CO32- + H2O 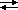 HCO3- + OH-
HCO3- + OH-
La phénolphtaléine se colore en rose : le pH de la solution est donc supérieur à 8,2 .
La basicité de ce pH provient de l'apparition des ions hydroxydes (OH-).
La basicité de ce pH provient de l'apparition des ions hydroxydes (OH-).
2. On ajoute progressivement une solution d'acide chlorhydrique à la solution précédente.
2. a. Après avoir placé les couples sur une échelle de pKa, indiquer la réaction qui se produit au début ; écrire l'équation-bilan correspondante.
Les espèces présentes dans la solution sont en gras :
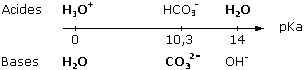
La base la plus forte (CO32-) réagissant avec l'acide le plus fort (H3O+), la réaction prépondérante est :
CO32- + H3O+ 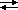 HCO3- + H2O (1)
HCO3- + H2O (1)
2. b. Calculer la constante de cette réaction et vérifier qu'elle est quantitative.
On a :
Donc K = 10pKa = 1010,3 = 2.1010
Comme K est très grand devant 1, la réaction (1) est totale ou quantitative.
2. c. Lorsque la solution devient incolore (pH = 8,2), vérifier que l'on peut considérer que tous les ions carbonate (CO32-) ont été transformés (pour cela, on pourra calculer le rapport des concentrations [HCO3-]/[CO32-] à pH = 8,2).
Explicitons la relation entre pH, pKa et le rapport [HCO3-]/[CO32-] :
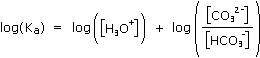
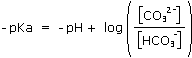
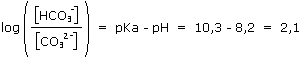
A pH = 8,2 , le rapport [HCO3-]/[CO32-] est supérieur à 100.
On peut donc considérer que tous les ions carbonate (CO32-) ont été transformés en ions hydrogénocarbonate (HCO3-).
On peut donc considérer que tous les ions carbonate (CO32-) ont été transformés en ions hydrogénocarbonate (HCO3-).
II. Basicité d'une lessive sans phosphate
Le tripolyphosphate de sodium est très utilisé depuis une quarantaine d'années dans les lessives. Son rôle est double : il maintient un milieu basique nécessaire pour l'efficacité des détergents, et séquestre les ions Ca2+ évitant ainsi les phénomènes de redéposition.
Mais il est en partie responsable de l'eutrophisation des lacs et rivières. Son emploi est maintenant interdit dans certains pays, limité dans d'autres.
Dans les lessives sans phosphate, l'emploi de carbonate de sodium associé à d'autres composés maintient un milieu basique et évite la redéposition.
Mais il est en partie responsable de l'eutrophisation des lacs et rivières. Son emploi est maintenant interdit dans certains pays, limité dans d'autres.
Dans les lessives sans phosphate, l'emploi de carbonate de sodium associé à d'autres composés maintient un milieu basique et évite la redéposition.
Expérience :
On réalise 100 mL d'une solution de lessive dans une fiole jaugée en dissolvant 1,0 g de lessive dans de l'eau distillée puis en complétant au trait de jauge. On ajoute une goutte de phénolphtaléine. La solution est rose. On supposera que la basicité de la solution ne résulte que du carbonate de sodium.
On prélève 20,0 mL de la solution et on ajoute lentement une solution d'acide chlorhydrique de concentration 0,10 mol.L-1. La solution devient incolore lorsqu'on a versé 6,0 mL de solution acide.
On prélève 20,0 mL de la solution et on ajoute lentement une solution d'acide chlorhydrique de concentration 0,10 mol.L-1. La solution devient incolore lorsqu'on a versé 6,0 mL de solution acide.
1. En utilisant les résultats de la question I-2, calculer la quantité (en mol) d'ions présents dans 1,0 gramme de lessive.
La réaction de dosage est la réaction CO32- + H3O+ 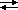 HCO3- + H2O .
HCO3- + H2O .
Cette réaction est quantitative, d'après la question 2. a. .
La solution se décolore quand les ions carbonates (CO32-) ont disparu, donc, d'après les coefficients stoechiométriques de la réaction, quand la quantité d'ions hydroniums (H3O+) nac introduits (par l'acide chlorhydrique versée) est égale à la quantité d'ions carbonates (CO32-) nbas présents dans le prélèvement de 20 mL, c'est à dire quand nac = nbas .
Or, la quantité nbas d'ions carbonates (CO32-) provient du prélèvement de 20mL de la solution initiale qui avait un volume de 100mL, donc le nombre de moles total d'ions carbonates (CO32-) contenu dans ces 100mL de solution est : nini = 5 nbas ,
donc comme nbas = nac , on a nini = 5 nac .
Soit cac la concentration de la solution d'acide chlorhydrique et vac le volume de la solution versé jusqu'à la décoloration de la phénolphtaléine.
On a nac = cac vac , donc :
nini = 5 cac vac
Application numérique :
nini = 5 cac vac = 5 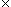 0,1
0,1 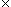 6.10-3 = 3.10-3 mol
6.10-3 = 3.10-3 mol
2. En déduire le pourcentage en masse de carbonate de sodium dans la lessive étudiée.
La masse molaire du carbonate de sodium (Na2CO3) est :
M = 2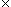 MNa + 1
MNa + 1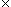 MC + 3
MC + 3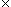 M0 = 2
M0 = 2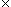 23 + 1
23 + 1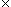 12 + 3
12 + 3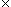 16 = 106 g.mol - 1.
16 = 106 g.mol - 1.
Soit mini la masse de carbonate de sodium contenu dans les 100mL de lessive. On a :
mini = nini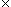 M = 3.10-3
M = 3.10-3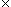 106 = 0,318 g
106 = 0,318 g
La solution avait été obtenue en versant 1 g de lessive dans 100 mL d'eau.
Le pourcentage en masse de carbonate de sodium dans la lessive est donc 31,8 % .
Copyright © School Angels 2001